Kiều Thị Tuyết Mai1, Nguyễn Công Minh1, Cao Thị Thùy Linh1, Lê Hồng Minh2, Nguyễn Phương Chi1
1 Trường Đại học Dược Hà Nội
2 Trung tâm Nghiên cứu và Đánh giá kinh tế y tế
TÓM TẮT
Đặt vấn đề: Bàng quang tăng hoạt là một hội chứng phổ biến, gây ra gánh nặng về sức khỏe và kinh tế to lớn cho bệnh nhân. Mirabegron là một thuốc mới với nhiều ưu điểm trên lâm sàng và tính chi phí – hiệu quả so với các thuốc kháng muscarinic trước đây – điển hình là solifenacin, thuốc điều trị bàng quang tăng hoạt duy nhất đang được Bảo hiểm Y tế chi trả. Tổng quan hệ thống này được thực hiện với mục tiêu tổng hợp các bằng chứng trên thế giới về hiệu lực, an toàn và chi phí – hiệu quả của mirabegron so với solifenacin trong điều trị bàng quang tăng hoạt.
Phương pháp nghiên cứu: Tài liệu được tìm kiếm toàn diện trên hai cơ sở dữ liệu PubMed và Web of Science cho đến tháng 10 năm 2022. Các nghiên cứu được đưa vào nếu báo cáo về hiệu lực, an toàn và chi phí – hiệu quả của mirabegron so với solifenacin thông quan các tiêu chí lựa chọn và loại trừ. Các bảng kiểm CONSORT, STROBE và CHEERS được sử dụng để đánh giá chất lượng nghiên cứu.
Kết quả nghiên cứu: Sau hai vòng lọc tiêu đề/tóm tắt và toàn văn, 16 nghiên cứu được lựa chọn cho tổng quan hệ thống về hiệu lực, an toàn và 4 nghiên cứu được lựa chọn cho tổng quan hệ thống về chi phí – hiệu quả. Các nghiên cứu về hiệu lực, an toàn bao gồm cả các thử nghiệm lâm sàng và nghiên cứu quan sát, được thực hiện tại nhiều quốc gia trên thế giới trên nhiều khu vực địa lý khác nhau. Các nghiên cứu đều cho thấy hiệu quả tương đương của mirabegron so với solifenacin nhưng mức độ dung nạp của mirabegron là tốt hơn. Các nghiên cứu về chi phí – hiệu quả đều cho thấy mirabegron đạt chi phí – hiệu quả so với solifenacin trong điều trị bàng quang tăng hoạt.
Kết luận: Các nghiên cứu trên thế giới chỉ ra rằng mirabegron có hiệu quả tương đương nhưng có mức độ dung nạp tốt hơn và đạt chi phí – hiệu quả khi so sánh với solifenacin trong điều trị bàng quang tăng hoạt.
Từ khóa: Bàng quang tăng hoạt, mirabegron, solifenacin, tổng quan hệ thống
1. ĐẶT VẤN ĐỀ
Theo Hiệp hội Tiêu tiểu tiện Tự chủ quốc tế năm 2019 (ICS – 2019), bàng quang tăng hoạt được định nghĩa là sự hiện diện của “tiểu gấp, thường đi kèm với gia tăng tần suất đi tiểu vào ban ngày và ban đêm, có hoặc không có kèm với tiểu không kiểm soát và không có nhiễm trùng đường tiết niệu hoặc các bệnh lý có thể phát hiện được khác” [7]. Ước tính vào năm 2018, trên thế giới có khoảng 546 triệu người đang sống chung với bàng quang tăng hoạt [12]. Về mặt sức khỏe, bàng quang tăng hoạt làm suy giảm đáng kể chất lượng cuộc sống người bệnh cả thể chất lẫn tinh thần. Hơn thế nữa, về mặt kinh tế, bàng quang tăng hoạt cũng tạo nên gánh nặng chi phí to lớn cho người bệnh. Ước tính vào năm 2007, chi phí cho bàng quang tăng hoạt ở Hoa Kỳ lên đến 65,9 tỷ USD [6].
Từ lâu, nhóm thuốc kháng muscarinic được coi là lựa chọn thuốc đường uống đầu tay và duy nhất trong điều trị bàng quang tăng hoạt, trong đó có thể kể đến solifenacin – một thuốc kháng muscarinic điển hình đã được đưa vào Danh mục thuốc được Bảo hiểm Y tế Việt Nam chi trả. Cho đến năm 2012, FDA lần đầu tiên cấp phép cho một thuốc có cơ chế hoàn toàn khác biệt so với các kháng muscarinic là mirabegron – một chất chủ vận trên thụ thể β3 giao cảm với nhiều ưu điểm trên lâm sàng và kinh tế. Cho đến hiện nay, mirabegron đã được cấp phép tại trên 80 quốc gia trên thế giới, trong đó có Việt Nam và đã được khuyến nghị bởi nhiều hướng dẫn điều trị uy tín trên thế giới [5].
Xuất phát từ những tiềm năng và thực tế trên, nhóm nghiên cứu đã tiến hành thực hiện tổng quan hệ thống này với mục đích xem xét, đánh giá một cách có hệ thống các bằng chứng đã có trên thế giới về hiệu lực, an toàn và chi phí – hiệu quả của mirabegron so với solifeacin trong điều trị bàng quang tăng hoạt.
2. PHƯƠNG PHÁP NGHIÊN CỨU
2.1. Tổng quan hệ thống về hiệu lực, an toàn
Đối tượng của tổng quan hệ thống là các thử nghiệm lâm sàng hoặc các nghiên cứu quan sát đánh giá hiệu lực, hiệu quả và an toàn của mirabegron đơn trị so hoặc mirabegron kết hợp với solifenacin so sánh với solifenacin đơn trị trong điều trị bàng quang tăng hoạt và được báo cáo bằng tiếng Anh. Các bài báo được tìm kiếm trên 2 cơ sở dữ liệu là Pubmed và Web of Science (dữ liệu tính đến ngày 24/10/2022). Các tiêu chuẩn loại trừ bao gồm: các bài báo không phải là nghiên cứu gốc, nghiên cứu không được thực hiện trên người và các nghiên cứu không được công bố bằng tiếng Anh. Các nghiên cứu sau khi lựa chọn được đánh giá thông qua bảng kiểm CONSORT đối với RCT là bảng kiểm STROBE đối với nghiên cứu quan sát.
Các kết quả đầu ra về hiệu lực và an toàn của mirabegron so với solifenacin bao gồm: trung bình số lần đi tiểu không kiểm soát/24h, trung bình số lần đi tiểu/24h, thể tích trung bình mỗi lần đi tiểu (ml), trung bình số lần đi tiểu gấp/24h, trung bình số lần đi tiểu đêm/24h và các phản ứng có hại của thuốc.
Các dữ liệu được trích xuất bao gồm: đặc điểm của nghiên cứu, đặc điểm của bệnh nhân, kết quả đánh giá hiệu lực và an toàn của thuốc
2.2. Tổng quan hệ thống về chi phí – hiệu quả
Đối tượng của tổng quan hệ thống là các nghiên cứu kinh tế dược có đề cập đến tác động kinh tế của mirabegron so với solifenacin trong điều trị bàng quang tăng hoạt được công bố bằng tiếng Anh. Các bài báo cũng được tìm kiếm trên 2 cơ sở dữ liệu là Pubmed và Web of Science (dữ liệu tính đến ngày 24/10/2022).
Các nghiên cứu được lựa chọn bao gồm các phân tích chi phí – hiệu quả, chi phí – thỏa dụng, chi phí – lợi ích, chi phí – tối thiểu, chi phí bệnh tật. Các tiêu chí loại trừ bao gồm: các bài báo không phải là nghiên cứu gốc, các nghiên cứu không được thực hiện trên người, các nghiên cứu không được công bố bằng Tiếng Anh và các nghiên cứu thị trường. Các nghiên cứu sau khi lựa chọn sẽ được đánh giá thông qua bảng kiểm CHEERS.
Các dữ liệu được trích xuất bao gồm: các thông tin về đặc điểm cơ bản của các nghiên cứu, kết quả phân tích chi phí – hiệu quả và kết quả phân tích độ nhạy.
3. Kết quả nghiên cứu
3.1. Tổng quan hệ thống về hiệu lực, an toàn
3.1.1. Kết quả lựa chọn nghiên cứu
Sau khi tìm kiếm ở hai cơ sở dữ liệu Pubmed và Web of Science, nhóm nghiên cứu đã thu được 801 bài báo. Trải qua 2 vòng sàng lọc tiêu đề và tóm tắt và sàng lọc toàn văn, 16 nghiên cứu đã được lựa chọn (Hình 1).
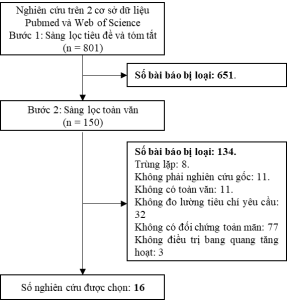
Hình 1. Quy trình lựa chọn các nghiên cứu đưa vào tổng quan hệ thống về hiệu lực, an toàn
3.1.2. Đánh giá chất lượng nghiên cứu
Các nghiên cứu đều có chất lượng khá tốt và đồng đều. 12 thử nghiệm lâm sàng đánh giá bằng bảng kiểm CONSORT đạt từ 17/25 điểm trở lên và 4 nghiên cứu quan sát được đánh giá bằng bảng kiểm STROBE đạt từ 16,5/22 điểm trở lên.
3.1.3. Đặc điểm các nghiên cứu
Đa số các nghiên cứu là các thử nghiệm lâm sàng ngẫu nhiên có đối chứng. Tuy nhiên cũng có 4 nghiên cứu quan sát được đưa vào tổng quan hệ thống lần này. Khoảng thời gian theo dõi từ 3 đến 12 tháng nhưng đa số được thực hiện trong 3 tháng. Tất cả các nghiên cứu đều được thực hiện trên đối tượng là người trưởng thành. Mirabegron được sử dụng ở 2 mức liều 25mg, 50mg đơn trị kết hợp với solifenacin 2,5mg, 5mg và 10mg và các kết hợp giữa các liều trên. Trong đó, các mức liều phổ biến là mirabegron 50mg, solifenacin 5mg và chế độ liều kết hợp giữa 2 đơn trị liệu trên (Bảng 1).
Nghiên cứu
|
Thiết kế NC
|
Can thiệp (mg)
|
Cỡ mẫu
|
Thời gian theo dõi
|
Quốc gia thực hiện
|
MIRA
|
SOLI
|
K/H1
|
Abrams, 2015 [1]
|
RCT
|
2550
|
2,5510
|
Tất cả các kết hợp
|
1.306
|
3
|
20 QG
|
Batista, 2015 [2]
|
RCT
|
50
|
5
|
1.421
|
3
|
33 QG
|
Drake, 2016 [4]
|
RCT
|
510
|
25/50 + 52
|
2.110
|
3
|
31 QG
|
Gratzke, 2018 [8]
|
RCT
|
50
|
5
|
50 + 5
|
1.794
|
12
|
28 QG
|
Herschorn, 2017 [10]
|
RCT
|
2550
|
5
|
25 + 550 + 5
|
3.398
|
3
|
41 QG
|
Inoue, 2019 [11]
|
RCT
|
50
|
5
|
47
|
3
|
Nhật Bản
|
Kosilov, 2015 [13]
|
RCT
|
50
|
10
|
50 + 10
|
239
|
3
|
Nga
|
Mueller, 2019 [15]
|
RCT
|
50
|
5
|
50 + 5
|
1.794
|
12
|
28 QG
|
Ozkidik, 2019 [17]
|
RCT
|
50
|
5
|
62
|
12
|
Thổ Nhĩ Kỳ
|
Tubaro, 2017 [19]
|
RCT
|
50
|
5
|
443
|
3
|
33 QG
|
Wang, 2021 [20]
|
RCT
|
50
|
5
|
61
|
12
|
Đài Loan
|
White, 2018 [21]
|
RCT
|
2550
|
5
|
25 + 550 + 5
|
2.969
|
2
|
33 QG
|
Chen, 2022 [3]
|
Thuần tập
|
50
|
5
|
50 + 5
|
64
|
6
|
Đài Loan
|
Maeda, 2015 [14]
|
Bệnh chứng
|
25
|
5
|
50
|
3
|
Nhật Bản
|
Striavi, 2018 [18]
|
Phân tích hồi cứu
|
50
|
5
|
342
|
3
|
Italia
|
Yamaguchi, 2015 [22]
|
Phase IV, nhãn mở
|
25 + 2,550 + 2,525 + 550 + 5
|
218
|
4
|
Nhật Bản
|
QG: Quốc gia; RCT (Randomized Clinical Trial): Thử nghiệm lâm sàng ngẫu nhiên có đối chứng;MIRA: Mirabegron, SOLI: Solifenacin.
1: Liều dùng MIRA + Liều dùng SOLI; 2: 4 tuần đầu dùng 25mg MIRA, 8 tuần sau dùng 50mg MIRA.
Bảng 1. Đặc điểm các nghiên cứu trong tổng quan hệ thống về hiệu lực, an toàn
3.1.4. Hiệu lực của mirabegron
Mirabegron đơn trị với vs. solifenacin đơn trị
Tất cả các so sánh trong các nghiên cứu đều chỉ ra rằng, không có sự khác biệt có ý nghĩa thống kê khi so sánh hiệu lực giữa mirabegron đơn trị và solifenacin đơn trị ở tất cả các mức liều (Bảng 2).
Nghiên cứu
|
Can thiệp (mg)
|
Kết quả
|
MIRA
|
SOLI
|
Trung bình số lần đi tiểu không kiểm soát/24h
|
Batista, 2015 [2]
|
50
|
5
|
p<0,05
|
Striavi, 2018 [18]
|
50
|
5
|
p<0,05
|
Kosilov, 2015 [13]
|
50
|
10
|
p<0,05
|
Trung bình số lần đi tiểu/24h
|
Abrams, 2015 [1]
|
25
|
5
|
p<0,05
|
Striavi, 2015 [18]
|
50
|
5
|
p<0,05
|
Thể tích trung bình mỗi lần đi tiểu (ml)
|
Abrams, 2015 [1]
|
50
|
5
|
p<0,05
|
Trung bình số lần đi tiểu gấp/24h
|
Striavi, 2018 [18]
|
50
|
5
|
p<0,05
|
Trung bình số lần đi tiểu điêm/24h
|
Striavi, 2018 [18]
|
50
|
5
|
p<0,05
|
Bảng 2. Kết quả so sánh hiệu lực giữa mirabegron đơn trị và solifenacin đơn trị
Kết hợp mirabegron + solifenacin vs. solifenacin
Đa số các so sánh ở các chế độ liều phổ biến đều chỉ ra rằng, kết hợp giữa mirabegron và solifenacin đều cho hiệu quả khác biệt có ý nghĩa thống kê với solifenacin đơn trị. Thậm chí, nghiên cứu của Drake và cộng sự còn chỉ ra rằng, chế độ liều kết hợp hiệu quả hơn solifenacin đơn trị 10mg ở 3/5 tiêu chí (Bảng 3) [4].
Nghiên cứu
|
TB số lần đi tiểu KKS/24h(95CI)
|
TB số lần đi tiểu/24h(95CI)
|
VTB mỗi lần đi tiểu (ml)(95CI)
|
TB số lần đi tiểu gấp/24h(95CI)
|
TB số lần đi tiểu đêm/24h(95CI)
|
MIRA 25/50mg + SOLI 5mg vs SOLI 5mg1
|
Drake, 2016 [4]
|
-0,26(-0,47 – -0,05)
|
-0,45(-0,67 – -0,22)
|
11,52(6,06 – 16,99)
|
-0,54(-0,83 – -0,25)
|
-0,06(-0,16 – 0,03)
|
MIRA 50mg + SOLI 5mg vs SOLI 5mg
|
Abrams, 2015 [1]
|
–
|
p>0,05
|
28,0(14,0 – 42,3)
|
p>0,05
|
–
|
Gratzke, 2018 [8]
|
-0,1(-0,4 – 0,1)
|
-0,4(-0,7 – -0,1)
|
12,8(6,0 – 19,6)
|
–
|
–
|
Herschorn, 2017 [10]
|
-0,20(-0,44 – 0,04)
|
-0,39(-0,67, -0,11)
|
–
|
–
|
–
|
MIRA 25/50mg + SOLI 5mg vs SOLI 10mg
|
Drake, 2016 [4]
|
-0,13(-0,34 – 0,08)
|
-0,47(-0,70 – -0,25)
|
7,75(2,29 – 13,21)
|
-0,40(-0,69 – -0,11)
|
-0,02(-0,11 – 0,07)
|
TB: Trung bình, KKS: Không kiểm soát, VTB: Thể tích trung bình, “-“: Không báo cáo
Bảng 3. Kết quả so sánh hiệu lực của kết hợp giữa mirabegron và solifeanacin với solifenacin đơn trị trong điều trị bàng quang tăng hoạt
3.1.5. An toàn của mirabegron
Tất cả các nghiên cứu trong tổng quan hệ thống về hiệu lực, an toàn đều báo cáo tác dụng không mong muốn. Không có trường hợp tử vong nào được báo cáo ở tất cả các chế độ liều trong nghiên cứu.
Với các biến cố bất lợi (BCBL) phổ biến (các biến cố bất lợi được báo cáo ở ít nhất 1 nghiên cứu đồng thời có số lượng gặp phải ≥ 10 trường hợp và tần suất gặp phải ≥ 4,0%) bao gồm: khô miệng, viêm mũi họng, nhiễm khuẩn đường tiết niệu, táo bón và tăng huyết áp. Tần suất cao nhất gặp phải các biến cố này (xét các trường hợp có từ 10 bệnh nhân gặp phải 1 biến cố bất lợi ở các chế độ liều phổ biến) được trình bày trong Bảng 4.
Khi xem xét các biến cố bất lợi thường gặp, nghiên cứu của Gratkze và cộng sự chỉ ra tỷ lệ gặp phải tình trạng khô miệng của solifenacin đơn trị nhiều hơn đáng kể so với mirabegron đơn trị [8]. Nghiên cứu của Schiavi và cộng sự cũng cho thấy tình trạng táo bón xảy ra ở bệnh nhân sử dụng solifenacin đơn trị nhiều hơn có ý nghĩa thống kê so với mirabegron đơn trị [18].
Chế độ liều
|
MIRA 50mg
|
SOLI 5mg
|
K/H
|
Tổng BCBL
|
52,6%
|
91,7%
|
58,1%
|
Khô miệng
|
3,9%
|
30,6%
|
8,0%
|
Viêm mũi họng
|
5,2%
|
5,5%
|
3,9%
|
NK đường TN
|
3,6%
|
4,0%
|
3,3%
|
Táo bón
|
2,2%
|
10,7%
|
3,2%
|
Tăng huyết áp
|
–
|
11,5%
|
3,6%
|
NK: Nhiễm khuẩn, TN: Tiết niệu; K/H: Kết hợp giữa MIRA 50mg và SOLI 5mg; “-“: Không có trường hợp nào ≥ 10 trường hợp.
Bảng 4. Tần suất gặp BCBL và BCBL phổ biến cao nhất ở các chế độ liều phổ biến.
Với chế độ liều kết hợp giữa mirabegron và solifenacin, nghiên cứu của Abrams và cộng sự chỉ ra không có sự khác biệt có liên quan các biến cố bất lợi giữa chế độ liều kết hợp với solifenacin hoặc mirabegron đơn trị [1]. Ngoài ra, nghiên cứu của Drake và cộng sự cũng chỉ ra tần suất khô miệng của chế độ liều kết hợp tăng dần mirabegron 25/50mg + solifenacin 5mg nhỏ hơn đáng kể so với chế độ liều tăng cường solifenacin 10mg [4].
3.2. Tổng quan hệ thống về chi phí – hiệu quả
3.2.1. Kết quả lựa chọn nghiên cứu
Sau khi tìm kiếm ở hai cơ sở dữ liệu Pubmed và Web of Science, nhóm nghiên cứu đã thu được 77 bài báo. Trải qua 2 vòng sàng lọc tiêu đề và tóm tắt và sàng lọc toàn văn, 4 nghiên cứu đã được lựa chọn (Hình 2).
3.2.2. Đánh giá chất lượng nghiên cứu
Các nghiên cứu đều có chất lượng khá tốt và đồng đều. 4 nghiên cứu được đánh giá bằng bảng kiểm CHEERS đều đạt từ 21,5/28 điểm trở lên.
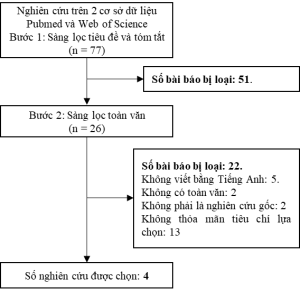
Hình 2. Quy trình lựa chọn các nghiên cứu đưa vào tổng quan hệ thống chi phí – hiệu quả
3.2.3. Đặc điểm các nghiên cứu
Các nghiên cứu được thực hiện ở Anh, Canada và Hoa Kỳ trong khung thời gian từ 1 – 5 năm. 3 trên 4 nghiên cứu có chi phí được báo cáo trong năm 2015, riêng nghiên cứu của Nazir và cộng sự là năm 2012. Hai nghiên cứu của Hakimi và cộng sự và Nazir và cộng sự (2017) chỉ tính toán chi phí và nghiên cứu trên quan điểm xã hội. Mặt khác, hai nghiên cứu của Nazir và cộng sự (2015) và Wielage và cộng sự (2016) có bao gồm phân tích về chi phí – hiệu quả và được thực hiện trên quan điểm của cơ quan chi trả (Bảng 5).
3.2.4. Kết quả phân tích chi phí – hiệu quả
Cả 2 nghiên cứu tính toán chi phí đều cho thấy mặc dù chi phí thuốc của mirabegron cao hơn solifenacin nhưng khi xem xét chi phí gián tiếp và tổng chi phí, mirabegron lại là lựa chọn tiết kiệm hơn [9], [16].
Hơn thế nữa, 2 nghiên cứu còn lại đều cho thấy mirabegron vượt trội hoặc đạt chi phí – hiệu quả khi so sánh với solifenacin ở trường hợp cơ bản (Bảng 6).
Nghiên cứu
|
Quốc gia
|
Khung TG
|
TLCK
|
Quan điểm NC
|
Năm BC
|
KQ đầu ra
|
Hakimi, 2017
|
Canada
|
1 năm
|
–
|
Xã hội
|
2015
|
Chi phí
|
Nazir, 2017
|
Anh
|
1 năm
|
–
|
Xã hội
|
2015
|
Chi phí
|
Nazir, 2015
|
Anh
|
5 năm
|
3,5%
|
Cơ quan chi trả
|
2012
|
ICER
|
Wielage, 2016
|
Hoa Kỳ
|
3 năm
|
–
|
Cơ quan chi trả
|
2015
|
ICER
|
TG: thời gian, TLCK: Tỷ lệ chiết khấu, NC: nghiên cứu, BC: báo cáo, KQ; kết quả, “-“: Không báo cáo
Bảng 5. Đặc điểm các nghiên cứu trong tổng quan hệ thống về chi phí – hiệu quả
Nghiên cứu
|
∆ CP
|
∆ QALY
|
ICER
|
Ngưỡng chi trả
|
Kết luận
|
% đạt CPHQ (PSA)
|
Mirabegron 50mg vs. Solifenacin 5mg
|
Nazir, 2015
|
57,65 GBP
|
0,0045
|
12.857 GBP
|
20.000 GBP
|
Đạt
|
86.6%
|
Mirabegron 50mg vs. Solifenacin 10mg
|
Nazir, 2015
|
3,83 GBP
|
0,0105
|
367 GBP
|
20.000 GBP
|
Đạt
|
92,8%
|
Wielage, 20161
|
-8 USD
|
0,009
|
Trội
|
100.000 USD
|
Đạt
|
–
|
Wielage, 20162
|
96 USD
|
0,010
|
9.600 USD
|
Đạt
|
–
|
1: Quan điểm nhà cung cấp bảo hiểm tư nhân toàn phần, 2: Quan điểm nhà cung cấp bảo hiểm liên kết với Medicare.
CP: Chi phí, CPHQ: Chi phí hiệu quả, ICER: Tỷ số gia tăng chi phí – hiệu quả, PSA: phân tích độ nhạy xác suất, QALY: Năm sống điều chỉnh theo chất lượng cuộc sống, “-“: Không báo cáo
Bảng 6. Kết quả phân tích chi phí – hiệu quả
Kết quả phân tích độ nhạy
Khi xem xét phân tích độ nhạy xác suất (PSA), nghiên cứu này cũng chỉ ra mirabegron đạt chi phí – hiệu quả trong hầu hết các trường hợp giả định khi so sánh với solifenacin.
Bàn luận
Đối với tổng quan hệ thống về hiệu lực, an toàn, trong 16 nghiên cứu được chọn, có 8 nghiên cứu là kết quả của 5 thử nghiệm lâm sàng được tiến hành trên 20 quốc gia và vùng lãnh thổ trên khắp các châu lục. Không những vậy, các nghiên cứu này còn được thực hiện ở một số quốc gia có vị trí địa lý tương đồng với Việt Nam như Đài Loan, Phillipines, Thái Lan,… giup tăng tính tin cậy khi áp dụng vào bối cảnh Việt Nam [10].
Tất cả các nghiên cứu so sánh về hiệu lực giữa 2 đơn trị liệu đều cho thấy không có sự khác biệt giữa 2 thuốc trên tất cả các lứa tuổi, kể cả người cao tuổi, khẳng định lợi ích của cả 2 thuốc với đối tượng trên. Trong khi đó, kết quả so sánh giữa chế độ liều kết hợp có hiệu quả vượt trội hơn so với đơn trị liệu. Chế độ kết hợp này có thể giúp trì hoãn việc phải cần can thiệp tiêm BoNT-A ở bệnh nhân bàng quang tăng hoạt vốn tiềm ẩn nhiều nguy cơ về nhiễm khuẩn tiết niệu và phải đặt ống thông tiểu [4].
Về an toàn, mirabegron cho thấy mức độ an toàn tốt hơn đáng kể so với solifenacin và chế độ liều kết hợp là sự lựa chọn có mức độ dung nạp tốt hơn so với tăng liều solifenacin. Solifenacin nói riêng và nhóm thuốc kháng muscarinic nói chung có tỷ lệ tuân thủ rất thấp do gây ra rất nhiều tác dụng không mong muốn cho bệnh nhân. Thậm chí, các nghiên cứu trước đây còn chỉ ra rằng tỷ lệ ngừng điều trị sau 1 tháng đầu tiên sử dụng có thể lên đến 83% [9]. Việc có tần suất BCBL thấp cho thấy lợi ích tiềm năng của thuốc này trong phác đồ điều trị bàng quang tăng hoạt, giúp gia tăng tỷ lệ tuân thủ điều trị ở nhóm bệnh nhân này.
Mặt khác, đối với tổng quan hệ thống về chi phí – hiệu quả, 2 nghiên cứu tính toán chi phí đều chỉ ra rằng mirabegron là sự lựa chọn tiết kiệm hơn so với solifenacin khi xem xét tổng chi phí. Các kết quả của 2 nghiên cứu phân tích ICER cũng đã khẳng định tính chi phí – hiệu quả của mirabegron. Tuy nhiên, các nghiên cứu này được thực hiện ở các quốc gia phát triển nên cần thận trọng khi áp dụng vào Việt Nam.
Kết luận
Về hiệu lực, mirabegron có hiệu lực ngang bằng với solifenacin và chế độ liều kết hợp 2 thuốc có hiệu quả đáng kể so với solifenacin đơn trị. Về an toàn, mirabegron ít đem lại tác dụng không mong muốn hơn so với solifenacin và chế độ liều kết hợp có mức độ an toàn tốt hơn so với liều cao solifenacin.
Về chi phí – hiệu quả, mirabegron là sự lựa chọn tiết kiệm hơn khi xem xét tổng chi phí và đạt chi phí – hiệu quả khi so sánh với solifenacin.
Tài liệu tham khảo
-
Abrams P., Kelleher C., et al. (2015), “Combination treatment with mirabegron and solifenacin in patients with overactive bladder: efficacy and safety results from a randomised, double-blind, dose-ranging, phase 2 study (Symphony)”, Eur Urol, 67(3), pp. 577-88.
-
Batista J. E., Kolbl H., et al. (2015), “The efficacy and safety of mirabegron compared with solifenacin in overactive bladder patients dissatisfied with previous antimuscarinic treatment due to lack of efficacy: results of a noninferiority, randomized, phase IIIb trial”, Ther Adv Urol, 7(4), pp. 167-79.
-
Chen S. F., Chuang Y. C., et al. (2022), “Therapeutic efficacy and cognitive adverse events of overactive bladder medication in patients with central nervous system Disorders-A cohort study”, J Formos Med Assoc, 121(10), pp. 2101-2108.
-
Drake M. J., Chapple C., et al. (2016), “Efficacy and Safety of Mirabegron Add-on Therapy to Solifenacin in Incontinent Overactive Bladder Patients with an Inadequate Response to Initial 4-Week Solifenacin Monotherapy: A Randomised Double-blind Multicentre Phase 3B Study (BESIDE)”, Eur Urol, 70(1), pp. 136-145.
-
-
Ganz M. L., Smalarz A. M., et al. (2010), “Economic costs of overactive bladder in the United States”, Urology, 75(3), pp. 526-32, 532 e1-18.
-
Gormley (2019), “Diagnosis and treatment of overactive bladder (non-neurogenic) in adults: AUA/SUFU guideline. 2019”, Retrieved 16/03/2022, from https://www.auanet.org/guidelines/overactivebladder-(oab)-guideline.
-
Gratzke C., van Maanen R., et al. (2018), “Long-term Safety and Efficacy of Mirabegron and Solifenacin in Combination Compared with Monotherapy in Patients with Overactive Bladder: A Randomised, Multicentre Phase 3 Study (SYNERGY II)”, Eur Urol, 74(4), pp. 501-509.
-
Hakimi Z., Nazir J., et al. (2017), “Clinical and economic impact of mirabegron compared with antimuscarinics for the treatment of overactive bladder in Canada”, J Med Econ, 20(6), pp. 614-622.
-
Herschorn S., Chapple C. R., et al. (2017), “Efficacy and safety of combinations of mirabegron and solifenacin compared with monotherapy and placebo in patients with overactive bladder (SYNERGY study)”, BJU Int, 120(4), pp. 562-575.
-
Inoue M., Yokoyama T. (2019), “Comparison of Two Different Drugs for Overactive Bladder, Solifenacin and Mirabegron: A Prospective Randomized Crossover Study”, Acta Med Okayama, 73(5), pp. 387-392.
-
Irwin D. E., Kopp Z. S., et al. (2011), “Worldwide prevalence estimates of lower urinary tract symptoms, overactive bladder, urinary incontinence and bladder outlet obstruction”, BJU Int, 108(7), pp. 1132-8.
-
Kosilov K., Loparev S., et al. (2015), “A randomized, controlled trial of effectiveness and safety of management of OAB symptoms in elderly men and women with standard-dosed combination of solifenacin and mirabegron”, Arch Gerontol Geriatr, 61(2), pp. 212-6.
-
Maeda T., Kikuchi E., et al. (2015), “Solifenacin or mirabegron could improve persistent overactive bladder symptoms after dutasteride treatment in patients with benign prostatic hyperplasia”, Urology, 85(5), pp. 1151-1155.
-
Mueller E. R., van Maanen R., et al. (2019), “Long-term treatment of older patients with overactive bladder using a combination of mirabegron and solifenacin: a prespecified analysis from the randomized, phase III SYNERGY II study”, Neurourol Urodyn, 38(2), pp. 779-792.
-
Nazir J., Berling M., et al. (2017), “Economic Impact of Mirabegron Versus Antimuscarinics for the Treatment of Overactive Bladder in the UK”, Pharmacoecon Open, 1(1), pp. 25-36.
-
Ozkidik M., Coskun A., et al. (2019), “Efficacy and tolerability of mirabegron in female patients with overactive bladder symptoms after surgical treatment for stress urinary incontinence”, Int Braz J Urol, 45(4), pp. 782-789.
-
Schiavi M. C., Faiano P., et al. (2018), “Efficacy and tolerability of treatment with mirabegron compared with solifenacin in the management of overactive bladder syndrome: A retrospective analysis”, J Obstet Gynaecol Res, 44(3), pp. 524-531.
-
Tubaro A., Batista J. E., et al. (2017), “Efficacy and safety of daily mirabegron 50 mg in male patients with overactive bladder: a critical analysis of five phase III studies”, Ther Adv Urol, 9(6), pp. 137-154.
-
Wang C. C., Lee C. L., et al. (2021), “Adding mirabegron after intravesical onabotulinumtoxinA injection improves therapeutic effects in patients with refractory overactive bladder”, Low Urin Tract Symptoms, 13(4), pp. 440-447.
-
White W. B., Chapple C., et al. (2018), “Cardiovascular Safety of the beta(3) -Adrenoceptor Agonist Mirabegron and the Antimuscarinic Agent Solifenacin in the SYNERGY Trial”, J Clin Pharmacol, 58(8), pp. 1084-1091.
22. Yamaguchi O., Kakizaki H., et al. (2015), “Safety and efficacy of mirabegron as ‘add-on’ therapy in patients with overactive bladder treated with solifenacin: a post-marketing, open-label study in Japan (MILAI study)”, BJU Int, 116(4), pp. 612-22.
Tạp chí Y học Cộng đồng, Tập 65, Số chuyên đề 7, trang 246–254


