Ứng dụng trí tuệ nhân tạo (AI: Artificial Intelligence) trong công nghiệp Dược nói riêng và ngành Dược nói chung, mang lại nhiều cơ hội đột phá từ khám phá phân tử thuốc mới, thiết kế thử nghiệm lâm sàng cho đến cá nhân hóa điều trị…
Tuy nhiên, song song với đó là những thách thức không nhỏ về đạo đức và pháp lý mà các nhà quản lý, doanh nghiệp và nhà khoa học cần lưu ý. Có thể đề cập đến các khía cạnh dưới đây.
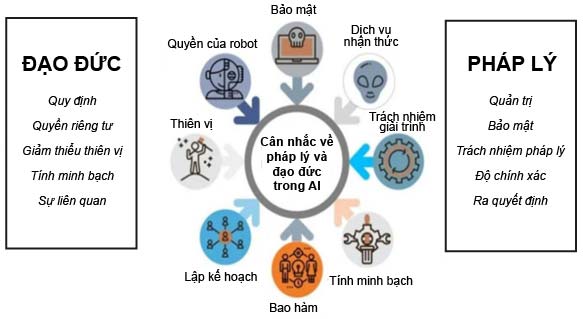
I. KHÍA CẠNH ĐẠO ĐỨC
1. Quyền riêng tư và bȧo mật dữ liệu
Ứng dụng AI trong phát triển thuốc thường dựa vào dữ liệu của bệnh nhân bao gồm: hồ sơ sức khỏe điện tử, dữ liệu lâm sàng, dữ liệu gen, dữ liệu sinh học phân tử... Những rủi ro lớn liên quan đến rò rỉ dữ liệu cá nhân, tái nhận dạng cá nhân, lạm dụng thông tin y tế cho mục đích thương mại… Vì vậy cần hết sức tuân thủ nguyên tắc ẩn danh hóa, mã hóa, đạt được sự đồng thuận rõ ràng khi sử dụng dữ liệu của người bệnh.
2. Công bằng và không phân biệt đối xử
Nếu dữ liệu huấn luyện AI thiếu tính đại diện và thiên lệch, thiên kiến (bias), kết quả nghiên cứu thuốc hay dự đoán hiệu quả điều trị có thể sai lệch, gây bất lợi cho một số quần thể bệnh nhân và dân cư. Nguyên tắc đạo đức yêu cầu đảm bảo tính công bằng, đa dạng và minh bạch trong dữ liệu và mô hình AI.
3. Trách nhiệm và minh bạch
Khi AI đưa ra gợi ý về thiết kế thuốc mới, dự báo tác dụng phụ, hoặc lựa chọn phác đồ điều trị… câu hỏi quan trọng nhất là: Ai sẽ chịu trách nhiệm khi sai sót xảy ra? Nhà khoa học, bác sĩ, hay công ty phát triển AI? Vì vậy, mô hình AI cần có giải thích (explainable AI) để thầy thuốc, dược sĩ và nhà quản lý hiểu cơ chế ra quyết định.
Hạn chế về tính minh bạch của thuật toán là mối quan tâm chi phối hầu hết các cuộc thảo luận pháp lý về trí tuệ nhân tạo. Sự gia tăng của AI trong các tình huống rủi ro cao đã làm tăng yêu cầu về thiết kế và quản trị AI có trách nhiệm, công bằng và minh bạch. Khả năng tiếp cận và tính dễ hiểu của thông tin là hai khía cạnh quan trọng nhất của tính minh bạch. Đã xẩy ra trong một số trường hợp, thông tin về chức năng của thuật toán thường bị người sử dụng AI cố tình hạn chế làm cho các bên liên quan khó tiếp cận.
4. Thử nghiệm lâm sàng và an toàn bệnh nhân
Sử dụng AI để rút ngắn thử nghiệm lâm sàng có thể tiềm ẩn rủi ro nếu bỏ qua các bước đánh giá an toàn. Cần bảo đảm rằng bệnh nhân tham gia thử nghiệm được thông tin đầy đủ và tự nguyện.
5. Ảnh hưởng xã hội
AI có thể làm thay đổi cấu trúc ngành dược phẩm, dẫn tới mất việc làm ở một số lĩnh vực như: nghiên cứu – phát triển thuốc theo các phương pháp truyền thống, sử dụng các phương pháp thống kê truyền thống… Cần chính sách tái đào tạo và tái bố trí nhân lực để thích ứng với kỷ nguyên chuyển đổi số.
II. KHÍA CẠNH PHÁP LÝ
Các cơ quan quản lý dược trên thế giới và người tiêu dùng nói riêng, công chúng nói chung, bày tỏ quan ngại về các khía cạnh pháp lý khi áp dụng AI trong lĩnh vực Dược, nói riêng và lĩnh vực chăm sóc sức khỏe, nói chung. Mối quan ngại lớn nhất là việc sử dụng AI không đúng chuẩn mực có thể khiến chúng ta “không còn có ai để quy trách nhiệm cho bất kỳ thiệt hại nào đã gây ra” cho người bệnh và người tiêu dùng. Mức độ nguy hiểm vẫn chưa được biết rõ, và việc sử dụng AI một cách máy móc, không minh bạch, thậm chí vô trách nhiệm sẽ hạn chế nghiêm trọng khả năng quy trách nhiệm và chịu trách nhiệm về việc ra quyết định của chúng ta.
1. Quy định về dữ liệu
Phải tuân thủ các luật bảo vệ dữ liệu cá nhân như Luật An ninh mạng và bảo vệ dữ liệu cá nhân (Việt Nam, 2023), Quy định chung về bảo mật dữ liệu (GDPR: General Data Protection Regulation – EU, 2018), Đạo luật về trách nhiệm giải trình và cung cấp thông tin y tế (HIPAA: Health Insurance Portability and Accountability, USA, 1996)… Các công ty Dược cần có hệ thống lưu trữ và xử lý dữ liệu đáp ứng chuẩn pháp lý quốc gia và quốc tế.
2. Quy định về nghiên cứu và phê duyệt thuốc
Các cơ quan quản lý như US FDA (Mỹ), EMA (Châu Âu), Bộ Y tế Việt Nam chưa có khung pháp lý hoàn thiện cho việc sử dụng AI trong nghiên cứu – phát triển, đánh giá hồ sơ đăng ký thuốc và phê duyệt thuốc. Vấn đề quan trọng là cần xác định AI là công cụ hỗ trợ hay là một phần của bằng chứng khoa học trong hồ sơ đăng ký thuốc.
Gần đây, Cơ quan quản lý dược Châu Âu (EMA) vừa mới ban hành dự thảo quy chế liên quan đến ứng dụng AI trong sản xuất dược phẩm để lấy ý kiến công chúng và công nghiệp dược (GMP EU Annex 22, Artificial Intelligence, Draft , 2025).
3. Quyền sở hữu trí tuệ (Intelectual Property)
Khi AI “sáng chế” ra một phân tử thuốc mới, câu hỏi đặt ra là bằng sáng chế thuộc về ai: Công ty lập trình AI, người vận hành, hay chính thuật toán (algorithm). Hiện nay, nhiều quốc gia chưa công nhận AI là chủ thể pháp lý có quyền sáng chế vì vậy cần có khung pháp lý mới.
4. Trách nhiệm pháp lý khi xȧy ra sai sót
Nếu AI phát triển được một thuốc mới nhưng gây ra tác dụng phụ nghiêm trọng ngắn hạn, lâu dài hoặc tử vong, trách nhiệm pháp lý sẽ thuộc về: Nhà phát triển phần mềm, Công ty dược sử dụng AI hay Cơ quan quản lý đã phê duyệt thuốc? Vấn đề này còn bỏ ngỏ, cần cơ chế và quy định pháp lý về chia sẻ và chịu trách nhiệm trong những trường hợp nói trên.
5. Chuẩn mực quốc tế và hài hòa hóa luật pháp
Trong quá trình quản lý sử dụng AI trong ngành Dược, mỗi quốc gia có thể có những khuôn khổ pháp lý và quy định khác nhau, thậm chí có quốc gia chưa có khung pháp lý. Vì vậy, cần hướng tới ban hành và hài hòa chuẩn mực toàn cầu về ứng dụng AI trong ngành Dược để hạn chế các rào cản hoặc xung đột pháp lý giữa các quốc gia và khu vực.
III. EMA/PIC-S, PHỤ LỤC 22 (BẢN DỰ THẢO)– CƠ SỞ PHÁP LÝ ỨNG DỤNG AI TRONG GMP DƯỢC PHẨM
Trong bối cảnh các tập đoàn và công ty dược phẩm đang nhanh chóng ứng dụng AI vào nghiên cứu – phát triển, thử nghiệm lâm sàng và sản xuất dược phẩm, các Cơ quan quản lý dược tiên tiến như US-FDA, EMA và PIC-S đang khẩn trương hoàn thiện khuôn khổ pháp lý và quy chế nhằm hướng dẫn các công ty sử dụng đúng đắn AI trong hoạt động của mình, trước hết là hoạt động sản xuất.
Phụ lục 22 – Bản dự thảo- là bản hướng dẫn đầu tiên về ứng dụng AI trong Thực hành tốt sản xuất thuốc (EudraLex Volume 4 GMP / GMP-PIC/S), vừa được công bố ngày 7 tháng 7 năm 2025 để xin ý kiến các bên liên quan. Phụ lục này áp dụng cho tất cả các loại hệ thống máy tính được sử dụng trong sản xuất dược phẩm và dược chất, trong đó các mô hình AI được sử dụng cho các ứng dụng quan trọng có tác động trực tiếp đến an toàn người bệnh, chất lượng sản phẩm và tính toàn vẹn dữ liệu.
Mục đích của Phụ lục 22 nhằm bổ sung và mở rộng hướng dẫn hiện có – Phụ lục 11 – Hệ thống máy tính, Chương 4, GMP – nhằm quản lý việc sử dụng AI/ML trong sản xuất dược phẩm, nguyên liệu dược (API: Active pharmaceutical Ingredient) và thuốc sinh học (biomedicines)…
Dự thȧo Phụ lục 22 bao gồm các nội dung quy định quan trọng sau:
1. Loại AI được cho phép áp dụng trong các ứng dụng quan trọng của GMP (critical GMP applications):
-
Chỉ áp dụng các mô hình tĩnh (static models): Sau khi đã huấn luyện, không tiếp tục học máy (no continuous/adaptive learning) trong khi vận hành.
-
Kết quả đầu ra mang tính quyết định (deterministic outputs): Cùng đầu vào – cùng đầu ra, không cho phép đầu ra xác suất hoặc biến đổi bất thường trong ứng dụng quan trọng.
2. Các loại AI / ML bị loại trừ khỏi ứng dụng quan trọng sau đây:
-
Mô hình động (dynamic models) tức là những mô hình tiếp tục học từ dữ liệu mới trong khi sử dụng.
-
Mô hình với kết quả đầu ra xác suất (probabilistic outputs) trong những ứng dụng ảnh hưởng đến chất lượng sản phẩm, an toàn người bệnh, tính toàn vẹn dữ liệu.
-
Không được sử dụng trí tuệ nhân tạo tạo sinh (Generative AI) và mô hình ngôn ngữ lớn (LLMs: Large Language Models) trong các chức năng GMP tối quan trọng (GMP critical). Nếu dùng cho các ứng dụng không quan trọng, cần phải có người kiểm soát, người thực hiện đánh giá đầu ra (human – in – the – loop) và đảm bảo điều kiện phù hợp.
3. Yêu cầu về dự kiến mục đích sử dụng (intended use) rõ ràng:
-
Cần xác định rõ việc AI sẽ tự động hóa cái gì, hỗ trợ cái gì.
-
Phȧi mô tả dữ liệu đầu vào (inputs): Các biến thể phổ biến hoặc ít gặp, giới hạn của dữ liệu, sự đa dạng, độ sạch và tính đại diện.
4. Xác định tiêu chí chấp nhận (acceptance criteria) và đo lường hiệu suất (performance metrics):
-
Trước khi triển khai, mô hình phải được thử nghiệm so với các tiêu chí định trước: độ chính xác (accuracy), độ nhạy (sensitivity), độ đặc hiệu (specificity)…
-
Dữ liệu thử nghiệm (test data) phải độc lập với dữ liệu huấn luyện, có tính đại diện, có quản lý kiểm soát truy cập, kiểm tra nhãn (labeling), nếu có.
5. Giȧi thích được và tính minh bạch (Explainability & Transparency):
-
Mô hình phải có khả năng giải thích: Xác định các đặc trưng (features) có ảnh hưởng đến đầu ra; khi đưa ra kết quả phải có thông tin về độ tin cậy (confidence scores).
6. Kiểm soát vận hành và theo dõi sau khi triển khai:
-
Kiểm soát thay đổi (change control) đối với mô hình / dữ liệu / cấu hình hệ thống.
-
Theo dõi hiệu suất (performance monitoring) để phát hiện hiện tượng “trôi mô hình” (drift) hoặc suy giảm mô hình (degradation).
-
Giám sát đầu vào mới để đảm bảo vẫn trong phạm vi đã được xác nhận (input space monitoring).
7. Vai trò giám sát của con người (human oversight / human-in-the-loop):
-
Dù mô hình có tự động hay hỗ trợ, phải có người đủ trình độ đảm trách việc đánh giá đầu ra khi cần.
-
Người sử dụng phải được đào tạo, có chuyên môn.
8. Trách nhiệm và giám sát nhà cung cấp (supplier / vendor oversight)
-
Nếu sử dụng dịch vụ từ bên ngoài (vendor), vẫn phải đảm bảo các điều kiện GMP, kiểm soát hợp đồng, giám sát chất lượng.
Ý nghĩa & tác động của Phụ lục 22
-
Giúp tạo ra khung quản lý rõ ràng cho ứng dụng AI trong sản xuất dược phẩm, để vừa tận dụng công nghệ mới, vừa bảo đảm an toàn, chất lượng, tính toàn vẹn của dữ liệu.
-
Doanh nghiệp sẽ phải đánh giá lại nếu đang sử dụng mô hình AI động hoặc mô hình ngôn ngữ lớn (LLM: Large Language Model) trong các phần quan trọng của GMP – có thể phải thay đổi mô hình, giới hạn ứng dụng hoặc sử dụng với sự giám sát chặt chẽ hơn.
-
Tăng nhu cầu về chuyên môn nội bộ (data science, AI/ML), sự phối hợp giữa các bộ phận quản lý chất lượng (QA), công nghệ thông tin (IT), sản xuất và quản lý rủi ro (risk management).
-
Quản lý tài liệu, dữ liệu thử nghiệm và giám sát liên tục sẽ trở nên phức tạp hơn về mặt quy trình, ghi chép và kiểm tra.
IV. CÁC GIẢI PHÁP TRONG TƯƠNG LAI
-
Cơ quan quản lý dược quốc gia xây dựng khung pháp lý linh hoạt nhưng chặt chẽ cho ứng dụng AI trong ngành Dược nói chung và Công nghiệp Dược phẩm nói riêng
-
Tăng cường đạo đức trong nghiên cứu khoa học. Củng cố hoặc thành lập Hội đồng thẩm định đối với các dự án AI liên quan đến dược phẩm nói riêng và ngành Dược nói chung
-
Khuyến khích minh bạch thuật toán, nguồn dữ liệu
-
Thúc đẩy hợp tác quốc tế để hình thành hoặc hài hòa tiêu chuẩn quản lý và khung pháp lý chung.
Tóm lại, để triển khai rộng rãi ứng dụng AI trong ngành Dược, cần hết sức quan tâm đến các khía cạnh sau:
-
Đạo đức: Bảo mật dữ liệu, công bằng, trách nhiệm, an toàn bệnh nhân, trách nhiệm giải trình, tác động xã hội…
-
Pháp lý: Quản lý dữ liệu cá nhân, quy trình phê duyệt thuốc, quyền sở hữu trí tuệ, xác định trách nhiệm khi xẩy ra sai sót, tuân thủ các chuẩn mực quốc gia và quốc tế…
-
Định hướng: Minh bạch, xây dựng khung pháp lý, tăng cường thẩm định, hợp tác quốc tế, đào tạo nguồn nhân lực…
Như vậy, ứng dụng AI trong ngành Dược nói chung và Công nghiệp Dược nói riêng, vừa mở ra triển vọng lớn, vừa đặt ra thách thức về quyền riêng tư của người bệnh, công bằng, trách nhiệm và pháp lý của các bên (stakeholders) liên quan.
Việt Nam cần từng bước xây dựng mới và/hoặc bổ sung, sửa đổi các quy định pháp lý liên quan đến ứng dụng AI trong ngành Dược, trước mắt là ứng dụng AI trong Thực hành tốt sản xuất thuốc (GMP) nói riêng và các sản phẩm bảo vệ sức khỏe nói chung như thực phẩm chức năng, mỹ phẩm…
TÀI LIỆU THAM KHẢO CHÍNH
[1] WHO, Benefits and risks of using artificial intelligence for pharmaceutical development and delivery (2023)
[2] FDA Draft Guidance, Considerations for the Use of AI to Support Regulatory Decision-Making for Drugs and Biologics (2025)
[3] FUTURE-AI Guideline, International consensus guideline for trustworthy and deployable AI in healthcare (2023)
[4] Nithesh Naik et al. Legal and Ethical Considerations in Healthcare: Who takes Responsibility, National Library of Medicine (NIH), Doi:10.3389/ fsurg.2022.862.322
[5] EMA/PIC-S Annex 22, Artificial Intelligence (Draft), 2025
[6] Bộ Y Tế, Thông tư Số 35/2008/TT-BYT ngày 22-11-2008 của Bộ trưởng Bộ Y tế quy định về “Thực hành tốt sản xuất thuốc và nguyên liệu làm thuốc”, 2008
[7] Bộ Y tế, Thông tư Số 12/2022/TT-BYT ngày 21-11- về “Sửa đổi, bổ sung một số điều của Thông tư số 35/2018/TT-BYT ngày 22-11-2018 của Bộ trưởng Bộ Y tế quy định về “Thực hành tốt sản xuất thuốc, nguyên liệu làm thuốc”, 2022
[8] Bộ Y Tế, Thông tư Số 28/2025/TT-BYT ngày 01-7-2025 quy định về “Thực hành tốt sản xuất thuốc, nguyên liệu làm thuốc”, 2025
Tác giả:
PGS.TS.DS. Lê Văn Truyền – Chuyên gia cao cấp (Dược học)